Techniques
Culture cellulaire
- Établissement de cultures primaires colo-rectales à partir de biopsies endoscopiques ou chirurgicales
- Génération de cellules dendritiques humaines, macrophages, cellules lymphocytaires… à partir d’anneaux de cytaphérèses.
- Immortalisation par la technique EBV et culture de lymphocytes B humains
- Co-cultures (lymphocytes B et lymphocytes TFH, cellules dendritiques et lymphocytes T4, cellules dendritiques et cardiomyocytes, cardio-fibroblastes et cardiomyocytes, etc).
- Cardiomyocytes ventriculaires humains (lignée AC16)
- Fibroblastes cardiaques humains ventriculaires (primaires HCF-av)
- Cellules endothéliales veine ombilicale humaines (primaire HUVEC)
- Cellules musculaires lisses (artère coronaire humaine primaire HCASMC)
- Cellules proximales tubulaires rénales humaines (primaires RPTEC/TERT1 et lignée HK-2)
- Autre :
- Travail en hypoxie/réoxygénation
- Tests de mortalité, de prolifération cellulaire
- Systèmes d'expression hétérologues (HEK293, HeLa)
- Tests de migration cellulaire (verticale par inserts, plane par "wound-healing") (Fig. 1)
Analyses des Nanovésicules (EVs)
- Isolement par différentes méthodes (ultracentrifugation, kits..)
- Caractérisation des EVs (taille, quantité, contenu)
- Effets des EVs sur l'immunomodulation
Electrophysiologie cellulaire
Patch clamp en configurations « voltage-clamp » et « current-clamp » (Fig. 6 et 7)Cytométrie en flux :
Marquages multicouleurs, membranaire, intracellulaire, de signalisation, viabilité, apoptose, autophagie, prolifération, dosages CBA, test d’activation des basophiles (TAB)…Tri cellulaire
- Trieur cellulaire FACS Melody (BD Biosciences) sous PSM et équipé de 3 lasers (Bleu, Rouge, Violet) : 9 paramètres + FSC/SSC
- Tri possible en plaques (P384, P96, P48, P24, P6), 2 voies de tri en tubes (1,5 / 2 et 5 ml) ou directement sur lames de microscope.
- Mode « Single Cell » une cellule par puits pour le clonage
- Tri cellulaire magnétique (monocytes, lymphocytes B, T4, T8, neutrophiles…)
Tests fonctionnels sur les neutrophiles
Production de ROS, libération de protéases (PR3, Cat G, Elastase), formation de NET, marqueurs d’activationMicroscopie
Microscopie à fluorescence, confocale, électronique à transmission
Biologie moléculaire des acides nucléiques et des protéines
- Extraction acides nucléiques, protéines
- PCR, RT-PCR, qPCR
- HRM (génotypage SNP)
- Western Blot
- Expression de protéines recombinantes
- Zymographie en gélatine (Fig. 2)
- Séquençage des immunoglobulines (VH, VL, Fc) humaines et murines
- Expression d’Ig recombinantes avec système d’expression en cellules HEK et CHO
- Transformation bactérienne et amplification de plasmides
Immunologie
ELISA, ELISpot, Multiplex
Immunohistochimie – Immunocytochimie (Fig. 3-4-5)
 Figure 1 : Initial state of the scratch-wound assay for colorectal primary cells.
Figure 1 : Initial state of the scratch-wound assay for colorectal primary cells.
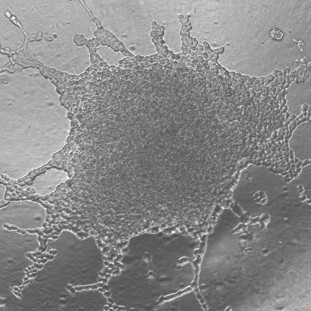
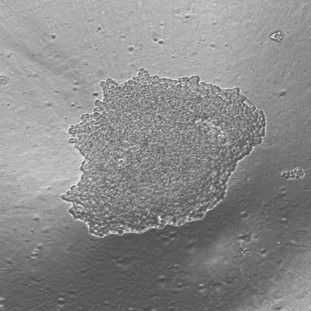 Spheroids for human cancer cells at the beginning of the video recording t = 0 and at the end of the experiment t = 48h.
Spheroids for human cancer cells at the beginning of the video recording t = 0 and at the end of the experiment t = 48h.
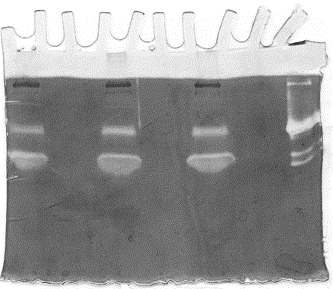 Figure 2: Gelatin zymogram for concentrated supernatants from cancer cell monolayer cultures.
Figure 2: Gelatin zymogram for concentrated supernatants from cancer cell monolayer cultures.
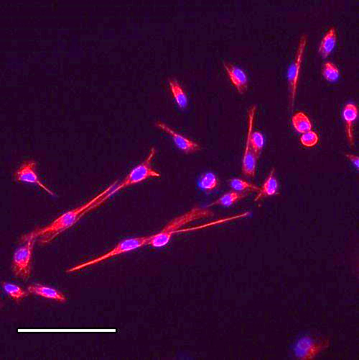

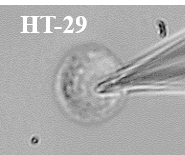
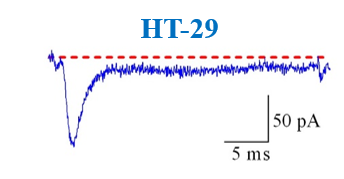
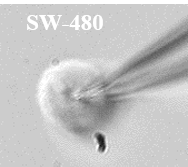
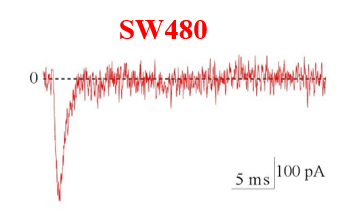
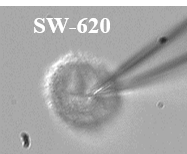
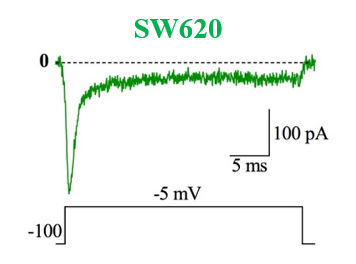
Figure 6 : Voltage gated sodium channels expressed in different colorectal cancer cell lines. Voltage-Clamp whole cell configuration.
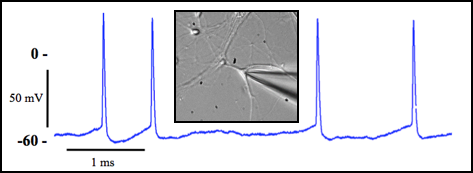
Figure 7 : Spontaneous action potentials (AP) obtained from hippocampal neurons. Current-clamp whole cell configuration.
